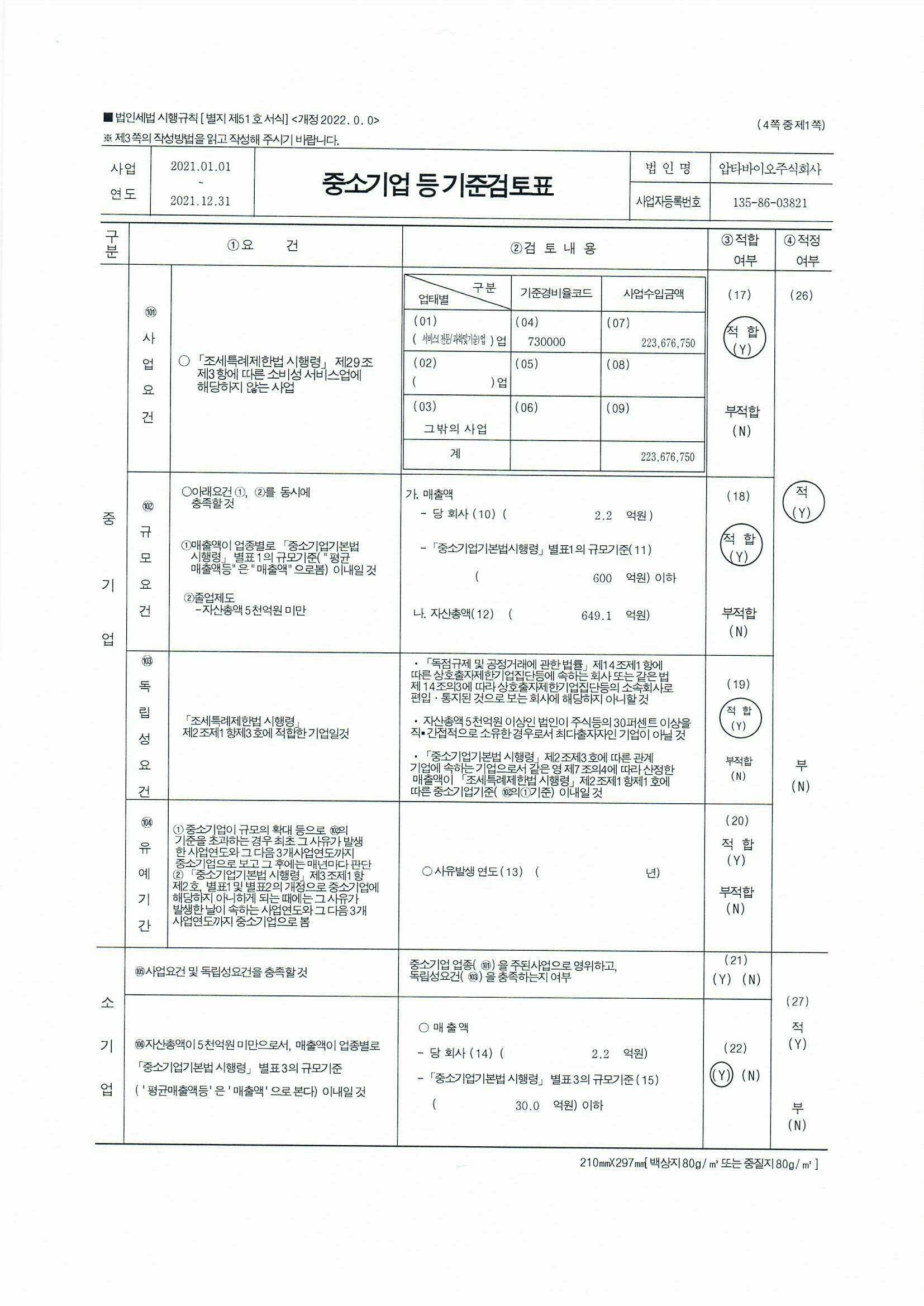
Lancellottip, MarechalP, DonisN, OuryC. Inflammation, cardiovasculardisease, andcancer: acommonlink with far-reachingimplications. Eur Heart J. 2019 Dec21; 40 (48) : 3910-3912. 심
혈관계(cardiovascular, CV) 위험인자와 염증, 암 간 연관성은 잘 확립돼 있다. 만성 염증은 초기 종양 미세 환경을 형성하고 암의 시작과 발달을 촉진함으로써 여러 암을 유발한다.[1, 2] 이 과정은 복잡한 종양-면역세포 상호작용을 포함하며 부분적으로 염증 해결 결함에 따른 것일 수 있다.[3] 특히 염증 환경에서 종양 발생률이 높은 기관은 종종 미생물과 밀접하게 상호작용하는 장이나 폐 등이다.
Relationship between cardiovascular risk factors, inflammation, cardiovascular disease, and cancer initiation/development.CVD, cerebrovascular disease; PAD, peripheral artery disease; CAD, coronary artery disease.
이번 European Heart Journal 문제에서 van’t Kluster 등은 안정형 CV의 질환(뇌혈관계, 말초혈관질환 또는 관상동맥질환)과 혈장 hsCRP(high sensitive C-reactive protein) 수준이 10mg/L 이하인 7178명의 환자에서 hsCRP의 혈장 수준으로 측정한 낮은 등급의 염증(low-grade inflammation)과 암 위험과의 연관성을 긍정적으로 평가했다.[4]암, 특히 폐암 발생률은 최초 5분위 hsCRP 수준을 보이는 환자와 비교해 마지막 5분위 내 hsCRP 수준을 가진 환자에서도 높았다. 염증이나 암, 간의 이런 관계는 현재 흡연자와 과거 흡연자에서 관찰됐지만 한 번도 흡연하지 않는 환자에서는 관찰되지 않았다. 이는 아테롬동맥경화증(atherosclerosis) 및 흡연과 관련하여 낮은 등급의 염증이 암 발생과 재발성 CV 사건과 관련된다는 첫 번째 임상적 입증이다.
전 세계적으로 흡연은 남성과 여성에서 폐암으로 인한 매년 169만명의 사망을 일으킨다. Framingham Heart Study에 대한 새로운 분석에 따르면 금연 후 25년이 지난 후에도 담배를 피워본 적이 없는 사람에 비해 암 위험이 3배나 높다. 하지만 금연 후 5년이 지나면 그 위험은 유의하는 것으로 감소했고, 흡연을 지속하는 것에 비해 시간이 지나면서 위험이 훨씬 감소했다.[5]낮은 등급의 염증이나 암 발생과의 관계가 흡연에 의해 촉진되는지 여부를 추가로 결정하기 때문에 반트 클루스터 연구 환자들의 평생 흡연 이력과 hsCRP 수준과의 연관성을 분석하는 것이 흥미롭다. 흥미롭게도 폐염증에 직접적인 영향을 미치는 것 외에 흡연은 장내 미생물을 변화시켜 폐염증 반응과 암 발생에 간접적으로 영향을 줄 수 있다.[6]또한 폐 감염에 의해 유발되는 국소 폐 군집의 붕괴(dysbiosis)는 또한 암 발생의 기초가 될 수 있다. 쥐에 대한 연구에서 국소 미생물총은 lung-resident γ Tcells를 활성화함으로써 종양의 성장을 촉진할 수 있다.[7]또한 전염증성 루멘 미생물은 아테롬 동맥경화증의 가속화와 관련이 있으며 [8] 암, CV 질환, 낮은 등급의 염증 사이의 흥미로운 공통적인 연관성이 있음을 시사한다.
암 진단, 모니터링, 예후 평가를 위한 새로운 도구로서 액체 생검(liquid biopsies)으로, [9]hsCRP 측정은 선택된 환자 집단에서 위험 감소 전략을 개선하는 데 도움이 될까? 또한 반트 클루스터 등의 발견은 CV 질환의 맥락에서 암 예방 그리고/또는 개선된 암의 결과를 향한 새로운 염증-표적 치료법을 향한 길을 밝힐 수 있다. CRP는 IL-6(interleukin-6), IL-1β, TGF-β(transforming growth factor-β) 등의 염증성 사이토카인의 상승에 반응하여 사이에서 생성된다. 급성관상동맥증후군(acutecoronary syndrome, ACS) 환자에서 이용 가능한 약물로 이들 사이토카인을 표적으로 하는 것이 ACS 시점 및 이후 CV 사건에서 염증 반응을 감소시킬 수 있는지를 평가하는 다양한 연구가 진행되어 왔다. 그 결과 hsCRP 수준은 이전에 ACS를 경험한 환자의 주요 CV 사건 또는 사망과 관련이 있었다. VISTA-16 study의 2차 분석에서 [10] ACS 이후 16주간 hsCRP 수준의 초기 및 후속 증가는 최적의 의료요법임에도 불구하고 주요 CV 사건의 endpoint, CV 사망, 모든 원인 사망의 더 높은 위험과 관련이 있었다. CANTO Strial에서 [11] 염증성 사이토카인 IL-1β를 표적으로 하는 therapeuticmonoclonalantibody인 canakinumab을 투여받은 기존 심근경색 병력이 있으면서 CRP 2mg/L 이상인 환자는 플라시보 환자에 비해 재발성 CV 사건 비율이 낮았다. 이 임상시험에서 카나키누맙은 또 폐암 발병률, 폐암 사망률, 총암 사망률을 낮췄다. 그리고 지금 발표된 반트 클루스터 등의 연구는 염증을 조절하는 것이 주요 CV 사건의 위험을 감소시킬 뿐만 아니라 암의 위험도 감소시킬 수 있다는 것을 강력하게 제안하는 것이다.
특정 항염증 요법은 다양한 악성 종양에서 유망한 결과를 보여 왔다.[12] CV질환 환자에서 저용량 아스피린 사용은 기간-의존적인 방법으로 암 위험을 줄이는 데 도움이 된다.[13] 보다 구체적으로는 5년 이상 저용량 아스피린을 복용하면 당뇨병이 없는 노인에서 폐암 발생 위험을 줄일 수 있다.[14] 스타틴 사용도 암 예방과 치료에 중요한 역할을 할 수 있다. 최근 몇 년간 진정한 돌파구는 CTLA-4 또는 PD-1/PD-L1을 표적으로 하는 면역관문 억제(immunecheckpoint blockade)였다. 하지만 ICB가 소수의 종양에 대해 임상적으로 매우 효과적이지만 대부분의 환자는 checkpoint in hibitors에 반응하지 않는다.[12] 핫투머스와 콜드투머스의 면역학적 상태는 ICB에 대한 종양 반응을 예측하는 데 결정적인 역할을 할 것으로 보인다. 오늘날 개별 환자의 ICB 감도를 예측하는 바이오마커를 확인하는 것이 가장 큰 과제 중 하나다. 따라서 반트 크루스터와 같은 연구에 따르면, 우리는 hsCRP가 임뮤노스코어[15] 또는 투모르쿨롬 컴포넌트[9]를 통한 종양 면역 특성 평가를 용이하게 할 수 있다고 추측할 수 있다.
절제 가능한 암의 경우 쥐에 대한 최근 연구에 따르면 전신 염증의 수술 전 억제 또는 염증 자극의 수술 전 억제를 통한 Tcelimunity의 촉발이 강력한 항종양 활성을 보이는 것으로 나타났다.[16] 따라서 수술 전 CRP 수준을 낮추는 요법은 기존 치료법과 함께 사용돼 암 결과를 개선하는 데 도움이 될 수 있다. 마지막으로 IL-6 또는 TGF-β와 같이 CRP를 유발하는 여러 사이토카인의 수준이나 IL-1β의 수준이 암 발병률과 CV 위험 증가와 관련이 있는지, 그리고 이러한 사이토카인이 환자의 결과를 예측할 수 있는지는 여전히 더 연구되어야 한다.Reference[1] Wang D, DuBois RN. Role of prostanoids in gastrointestinal cancer. J Clin Invest 2018;128:2732–2742.[2] Karin M, Greten FR. NF-kappa B: linking inflammation and immunity to cancer development and progression. Nat Rev Immunol 2005;5:749–759.[3] Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature 2014;510:92–101.[4] van’t Klooster CC, Ridker PM, Hjortnaes J, van der Graaf Y, Asselbergs FW, Westerink J, Aerts JGJV, Visseren FLJ; on behalf of the UCC-SMART study group. The relation between systemic inflammation and incident cancer in patients with stable cardiovascular disease: a cohort study. Eur Heart J 2019;40:3901–3909.[5] Tindle HA, Stevenson Duncan M, Greevy RA, Vasan RS, Kundu S, Massion PP, Freiberg MS. Lifetime smoking history and risk of lung cancer: results from the Framingham Heart Study. J Natl Cancer Inst 2018;110:1201–1207.[6] Bingula R, Filaire M, Radosevic-Robin N, Berthon JY, Bernalier-Donadille A, Vasson MP, Thivat E, Kwiatkowski F, Filaire E. Characterisation of gut, lung, and upper airways microbiota in patients with non-small cell lung carcinoma: study protocol for case–control observational trial. Medicine (Baltimore) 2018;97:e13676.[7] Jin C, Lagoudas GK, Zhao C, Bullman S, Bhutkar A, Hu B, Ameh S, Sandel D, Liang XS, Mazzilli S, Whary MT, Meyerson M, Germain R, Blainey PC, Fox JG, Jacks T. Commensal microbiota promote lung cancer development via cd T cells. Cell 2019;176:998–1013.[8] Brandsma E, Kloosterhuis NJ, Koster M, Dekker DC, Gijbels MJJ, van der Velden S, Rios-Morales M, van Faassen MJR, Loreti MG, de Bruin A, Fu J, Kuipers F, Bakker BM, Westerterp M, de Winther MPJ, Hofker MH, van de Sluis B, Koonen DPY.A proinflam
Relationship between cardiovascular risk factors, inflammation, cardiovascular disease, and cancer initiation/development.CVD, cerebrovascular disease; PAD, peripheral artery disease; CAD, coronary artery disease.
이번 European Heart Journal 문제에서 van’t Kluster 등은 안정형 CV의 질환(뇌혈관계, 말초혈관질환 또는 관상동맥질환)과 혈장 hsCRP(high sensitive C-reactive protein) 수준이 10mg/L 이하인 7178명의 환자에서 hsCRP의 혈장 수준으로 측정한 낮은 등급의 염증(low-grade inflammation)과 암 위험과의 연관성을 긍정적으로 평가했다.[4]암, 특히 폐암 발생률은 최초 5분위 hsCRP 수준을 보이는 환자와 비교해 마지막 5분위 내 hsCRP 수준을 가진 환자에서도 높았다. 염증이나 암, 간의 이런 관계는 현재 흡연자와 과거 흡연자에서 관찰됐지만 한 번도 흡연하지 않는 환자에서는 관찰되지 않았다. 이는 아테롬동맥경화증(atherosclerosis) 및 흡연과 관련하여 낮은 등급의 염증이 암 발생과 재발성 CV 사건과 관련된다는 첫 번째 임상적 입증이다.
전 세계적으로 흡연은 남성과 여성에서 폐암으로 인한 매년 169만명의 사망을 일으킨다. Framingham Heart Study에 대한 새로운 분석에 따르면 금연 후 25년이 지난 후에도 담배를 피워본 적이 없는 사람에 비해 암 위험이 3배나 높다. 하지만 금연 후 5년이 지나면 그 위험은 유의하는 것으로 감소했고, 흡연을 지속하는 것에 비해 시간이 지나면서 위험이 훨씬 감소했다.[5]낮은 등급의 염증이나 암 발생과의 관계가 흡연에 의해 촉진되는지 여부를 추가로 결정하기 때문에 반트 클루스터 연구 환자들의 평생 흡연 이력과 hsCRP 수준과의 연관성을 분석하는 것이 흥미롭다. 흥미롭게도 폐염증에 직접적인 영향을 미치는 것 외에 흡연은 장내 미생물을 변화시켜 폐염증 반응과 암 발생에 간접적으로 영향을 줄 수 있다.[6]또한 폐 감염에 의해 유발되는 국소 폐 군집의 붕괴(dysbiosis)는 또한 암 발생의 기초가 될 수 있다. 쥐에 대한 연구에서 국소 미생물총은 lung-resident γ Tcells를 활성화함으로써 종양의 성장을 촉진할 수 있다.[7]또한 전염증성 루멘 미생물은 아테롬 동맥경화증의 가속화와 관련이 있으며 [8] 암, CV 질환, 낮은 등급의 염증 사이의 흥미로운 공통적인 연관성이 있음을 시사한다.
암 진단, 모니터링, 예후 평가를 위한 새로운 도구로서 액체 생검(liquid biopsies)으로, [9]hsCRP 측정은 선택된 환자 집단에서 위험 감소 전략을 개선하는 데 도움이 될까? 또한 반트 클루스터 등의 발견은 CV 질환의 맥락에서 암 예방 그리고/또는 개선된 암의 결과를 향한 새로운 염증-표적 치료법을 향한 길을 밝힐 수 있다. CRP는 IL-6(interleukin-6), IL-1β, TGF-β(transforming growth factor-β) 등의 염증성 사이토카인의 상승에 반응하여 사이에서 생성된다. 급성관상동맥증후군(acutecoronary syndrome, ACS) 환자에서 이용 가능한 약물로 이들 사이토카인을 표적으로 하는 것이 ACS 시점 및 이후 CV 사건에서 염증 반응을 감소시킬 수 있는지를 평가하는 다양한 연구가 진행되어 왔다. 그 결과 hsCRP 수준은 이전에 ACS를 경험한 환자의 주요 CV 사건 또는 사망과 관련이 있었다. VISTA-16 study의 2차 분석에서 [10] ACS 이후 16주간 hsCRP 수준의 초기 및 후속 증가는 최적의 의료요법임에도 불구하고 주요 CV 사건의 endpoint, CV 사망, 모든 원인 사망의 더 높은 위험과 관련이 있었다. CANTO Strial에서 [11] 염증성 사이토카인 IL-1β를 표적으로 하는 therapeuticmonoclonalantibody인 canakinumab을 투여받은 기존 심근경색 병력이 있으면서 CRP 2mg/L 이상인 환자는 플라시보 환자에 비해 재발성 CV 사건 비율이 낮았다. 이 임상시험에서 카나키누맙은 또 폐암 발병률, 폐암 사망률, 총암 사망률을 낮췄다. 그리고 지금 발표된 반트 클루스터 등의 연구는 염증을 조절하는 것이 주요 CV 사건의 위험을 감소시킬 뿐만 아니라 암의 위험도 감소시킬 수 있다는 것을 강력하게 제안하는 것이다.
특정 항염증 요법은 다양한 악성 종양에서 유망한 결과를 보여 왔다.[12] CV질환 환자에서 저용량 아스피린 사용은 기간-의존적인 방법으로 암 위험을 줄이는 데 도움이 된다.[13] 보다 구체적으로는 5년 이상 저용량 아스피린을 복용하면 당뇨병이 없는 노인에서 폐암 발생 위험을 줄일 수 있다.[14] 스타틴 사용도 암 예방과 치료에 중요한 역할을 할 수 있다. 최근 몇 년간 진정한 돌파구는 CTLA-4 또는 PD-1/PD-L1을 표적으로 하는 면역관문 억제(immunecheckpoint blockade)였다. 하지만 ICB가 소수의 종양에 대해 임상적으로 매우 효과적이지만 대부분의 환자는 checkpoint in hibitors에 반응하지 않는다.[12] 핫투머스와 콜드투머스의 면역학적 상태는 ICB에 대한 종양 반응을 예측하는 데 결정적인 역할을 할 것으로 보인다. 오늘날 개별 환자의 ICB 감도를 예측하는 바이오마커를 확인하는 것이 가장 큰 과제 중 하나다. 따라서 반트 크루스터와 같은 연구에 따르면, 우리는 hsCRP가 임뮤노스코어[15] 또는 투모르쿨롬 컴포넌트[9]를 통한 종양 면역 특성 평가를 용이하게 할 수 있다고 추측할 수 있다.
절제 가능한 암의 경우 쥐에 대한 최근 연구에 따르면 전신 염증의 수술 전 억제 또는 염증 자극의 수술 전 억제를 통한 Tcelimunity의 촉발이 강력한 항종양 활성을 보이는 것으로 나타났다.[16] 따라서 수술 전 CRP 수준을 낮추는 요법은 기존 치료법과 함께 사용돼 암 결과를 개선하는 데 도움이 될 수 있다. 마지막으로 IL-6 또는 TGF-β와 같이 CRP를 유발하는 여러 사이토카인의 수준이나 IL-1β의 수준이 암 발병률과 CV 위험 증가와 관련이 있는지, 그리고 이러한 사이토카인이 환자의 결과를 예측할 수 있는지는 여전히 더 연구되어야 한다.Reference[1] Wang D, DuBois RN. Role of prostanoids in gastrointestinal cancer. J Clin Invest 2018;128:2732–2742.[2] Karin M, Greten FR. NF-kappa B: linking inflammation and immunity to cancer development and progression. Nat Rev Immunol 2005;5:749–759.[3] Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature 2014;510:92–101.[4] van’t Klooster CC, Ridker PM, Hjortnaes J, van der Graaf Y, Asselbergs FW, Westerink J, Aerts JGJV, Visseren FLJ; on behalf of the UCC-SMART study group. The relation between systemic inflammation and incident cancer in patients with stable cardiovascular disease: a cohort study. Eur Heart J 2019;40:3901–3909.[5] Tindle HA, Stevenson Duncan M, Greevy RA, Vasan RS, Kundu S, Massion PP, Freiberg MS. Lifetime smoking history and risk of lung cancer: results from the Framingham Heart Study. J Natl Cancer Inst 2018;110:1201–1207.[6] Bingula R, Filaire M, Radosevic-Robin N, Berthon JY, Bernalier-Donadille A, Vasson MP, Thivat E, Kwiatkowski F, Filaire E. Characterisation of gut, lung, and upper airways microbiota in patients with non-small cell lung carcinoma: study protocol for case–control observational trial. Medicine (Baltimore) 2018;97:e13676.[7] Jin C, Lagoudas GK, Zhao C, Bullman S, Bhutkar A, Hu B, Ameh S, Sandel D, Liang XS, Mazzilli S, Whary MT, Meyerson M, Germain R, Blainey PC, Fox JG, Jacks T. Commensal microbiota promote lung cancer development via cd T cells. Cell 2019;176:998–1013.[8] Brandsma E, Kloosterhuis NJ, Koster M, Dekker DC, Gijbels MJJ, van der Velden S, Rios-Morales M, van Faassen MJR, Loreti MG, de Bruin A, Fu J, Kuipers F, Bakker BM, Westerterp M, de Winther MPJ, Hofker MH, van de Sluis B, Koonen DPY.A proinflam